Appearance
反应性中间体的反应
贡献者:彭玉婷;整理:陈妤婕
由于本节中描述的中间体是反应性的和潜在的不稳定的化合物,因此该程序描述了活性中间体的制备和随后的反应,而不仅仅是活性中间体。
草酰氯生成酸
通过氯化酸活化酸最直接的方法之一是将酸与草酰氯和催化量的DMF反应。这种反应速度快,并能释放出大量的气体,因此反应容器的充分排气是很重要的;它也是适度放热的,经常需要冷却。由于中间酸氯化物通常在硅胶上水解,反应可以首先将反应混合物放入甲醇中,然后用薄层色谱法检查酸的消失和甲酯的形成。
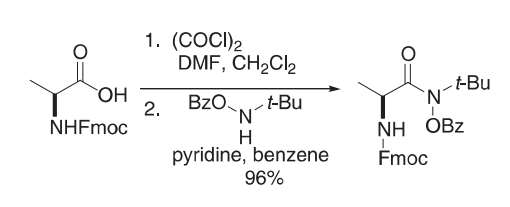
室温下,在Fmoc-L-丙氨酸(1.04 g,3.35 mmol)的二氯甲烷(5 mL)溶液中加入DMF(26µL),然后加入草酰氯(584µL,6.69 mmol)。一旦气泡消退,将黄色溶液加热至回流1.5 h。冷却后,溶液真空蒸发,固体残渣与苯共沸,然后溶于苯(6 mL)中。在该黄色溶液中加入N-叔丁基O-苯甲酰羟胺(0.71 g,3.68 mmol)的苯(5 mL)溶液,然后加入吡啶(541µL,6.69 mmol)。该混合物被加热到回流过夜,然后冷却。无色悬浮液在EtOAc和10%盐酸(水溶液)中分离,有机层用盐水洗涤,然后在硫酸镁上干燥。蒸发得到一种粘性、无色的油,通过闪光色谱(4:1己烷:乙酸)纯化,得到羟肟酸作为无色油(1.56 g,96%)。
参考文献: Braslau, R.; Axon, J. R.; Lee, B. Org. Lett. 2000, 2, 1399–1401.
三氯氧磷形成酸氯
三氯氧磷在制备酸性氯化物中的一个优点是没有气体产生。如下面的例子所示,碱性氮不干扰反应。
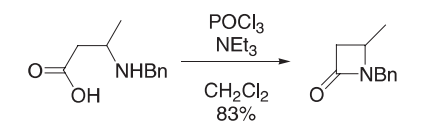
在二氯甲烷(25 mL)中加入氨基酸(193 mg,1 mmol)和三乙胺(418µL,3 mmol)的冷却溶液(0ºC)中,滴加三氯氧磷(460 mg,3 mmol),并在室温下搅拌反应混合物过夜。用饱和碳酸氢钠水(25 mL)、盐水(25 mL)和水(3×25 mL)洗涤。在无水硫酸钠上干燥和溶剂蒸发得到β-内酰胺(145 mg,83%)。
参考文献: Sharma, S. D.; Anand, R. D.; Kaur, G. Synth. Commun. 2004, 34, 1855–1862.
亚硫酰氯生成酸氯
亚硫酰氯比乙酰氯成本更低,释放出的气体也更少。
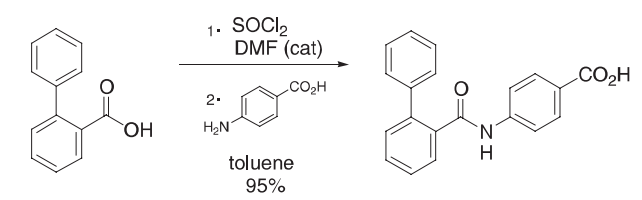
将亚硫酰氯(10.4 g,87.4 mmol)加入联苯-2-羧酸(15.0 g,75.7 mmol)和DMF(0.28 g,3.83 mmol)的混合物中,内温度为40ºC。将混合物在这个温度下搅拌大约2小时。反应完成后,将混合物在60ºC下浓缩至干燥。然后用甲苯(36 mL)稀释,在60ºC下浓缩至干燥,再次重复此过程,得到联苯-2-碳基氯作为油。在油中加入丙酮(100 mL),在25ºC的条件下加入4-氨基苯甲酸(10.4 g,75.8 mmol)和N,N-二甲基苯胺(10.1 g,83.3 mmol)。将混合物在这个温度下搅拌大约2小时。然后将水(100 mL)倒入混合物中,以25ºC搅拌1小时以上。通过过滤收集,在25ºC的DMF(100 mL)中溶解。然后过滤溶液去除不溶物质,将水(100 mL)倒入滤液中,25ºC搅拌约2h。通过过滤收集得到的晶体,在40ºC干燥,得到酰胺为白色晶体。
参考文献: Tsunoda, T.; Yamazaki, A.; Mase, T.; Sakamoto, S. Org. Process Res. Dev. 2005, 9, 593–598.
碳酸二咪唑活化
酰基咪唑啉酯可作为活化酸使用;它们经常被用于从酸中制备β-酮酯。最近的研究发现,二氧化碳显著提高了酰基咪唑胺与胺的反应速率(见 Vaidyanathan, R.; Kalthod, V. G.; Ngo, D. P.; Manley, J. M.; Lapekas, S. P.; J. Org. Chem. 2004, 69, 2565–2568).
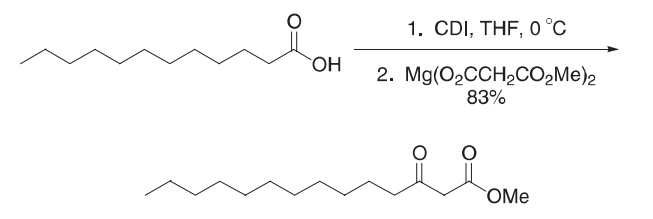
将羧酸(13.8 g,69 mmol,1.0当量)在惰性气氛下的干燥THF中溶解,并冷却至0ºC。然后将CDI(13.4 g,83 mmol,1.2当量)在几分钟内以小部分的形式加入。10 min后,让反应缓慢加热至室温,然后搅拌1h。在一个单独的烧瓶中,将单甲基丙二酸盐(9.8g,83 mmol,1.2当量)在惰性气氛下溶解在THF中,并冷却至−值78ºC。在该溶液中加入二丁基镁(1.0 M庚烷,0.6当量)。添加碱后立即形成白色固体。10 min后,将反应加热至室温,搅拌1h。然后用插管将酰基咪唑加入到含有镁盐的烧瓶中。将得到的浆液搅拌3天。然后将反应混合物浓缩在旋转蒸发器上,并将残渣重新溶解在乙酸乙酯中。所得溶液用1.2 M盐酸、饱和碳酸氢钠水溶液和盐水洗涤。有机相在硫酸钠上干燥,过滤,浓缩,用闪光色谱(7:1己烷:乙酸乙酯)纯化,得到β-keto酯(14.7g,83%)。
参考文献: Durham, T. B.; Miller, M. J. J. Org. Chem. 2003, 68, 27–34.
EDCI激活
1-乙基-3-[3-(二甲氨基)丙基]碳化二亚胺盐酸盐(EDCI),经常用于氨基酸偶联,是非常温和的,并导致最小的异聚化。EDCI在这里代表的是的是所有碳二亚胺偶联试剂。EDCI的优点是尿素副产物可以提取到酸性水中,然而从最终产物中多次完全去除尿素可能会有问题。
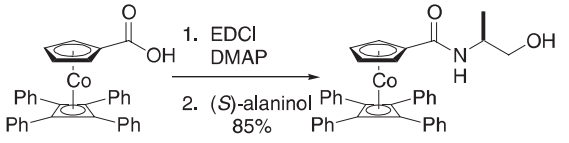
在氮气气氛下向二氯甲烷(30 mL)的酸(2.00 g,3.81 mmol)加入EDCI(0.880 g,4.59 mmol),N,N-二甲胺吡啶(DMAP 558 mg,4.57 mmol)和二氯甲烷(20 mL)的(S)丙氨酸醇(0.343 g,4.57 mmol),所得混合物在室温下搅拌48小时。加入10%的柠檬酸水溶液(20 mL),然后搅拌5 min。然后将混合物进行分离,干燥橙色有机馏分(硫酸钠),真空蒸发得到固体,通过柱层析(EtOAc)纯化得到酰胺为橙色结晶固体(1.88 g,85%)。
参考文献: Prasad, R. S.; Anderson,C.E.;Richards,C.J.;Overman,L.E.Organometallics 2005, 24, 77–81.
EEDQ激活
2-乙氧基-1-乙酯基-1,2- 二氢化氮杂萘(EEDQ)通过混合的酸酐激活酸,并产生喹啉、乙醇和二氧化碳作为副产物。与EDCI一样,反应的副产物喹啉可以提取到水酸性介质中。
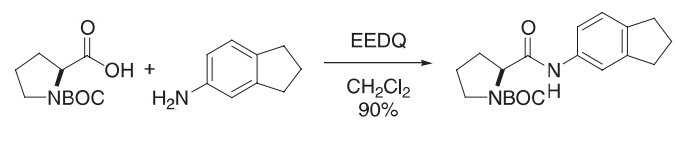
在N-BOC-L-脯氨酸(85 g,0.40 mol)和EEDQ(100 g,0.41 mol)溶液二氯甲烷(200 mL)中加入5-氨基丹(54 g,0.41 mol)。将反应混合物在0ºC下搅拌2h,然后在室温下反应过夜。用100 mL二氯甲烷稀释反应混合物,用1M盐酸(3×50 mL)、饱和水溶液碳酸氢钠(2×50 mL)、水(50 mL)和盐水(2×50 mL)洗涤。有机相在硫酸镁上干燥,过滤,浓缩得到粘性油。然后将粗产物重新溶解于1:1的ch2cl2/乙酸乙酯的混合物中。将混合物冷却至-10ºC,可得到酰胺(116 g,90%)为灰白色结晶固体。
参考文献: Ling, F. H.; Lu, V.; Svec, F.;Frechet,J.M.J.J.Org.Chem.2002,67,1993–2002.
异丁基氯甲酸酯活化
羧酸与氯甲酸异丁酯反应形成的混合酸酐往往比相应的氯化酸更稳定,因此α立体中心的异聚化最小化。
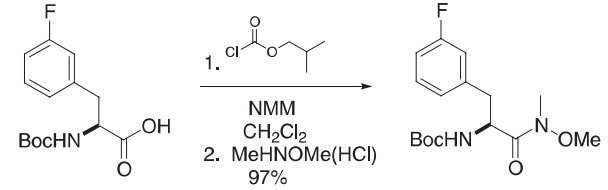
在一个装有添加漏斗、低温温度计、N2入口和机械搅拌器的1升四颈瓶中,N-BOC-(3-氟苯基)丙氨酸(56.6 g,0.2 mol)溶解在二氯甲烷(300 mL)中。n-甲基吗啉(23.05 mL,0.2 mol)缓慢加入,轻微放热量为18-24ºC。将溶液冷却至-25ºC,加入2-3 min以上的氯甲酸异丁酯(25.27 mL,0.2molmol),同时保持温度在−25~−20ºC之间。将反应混合物形成的沉淀在−20至−10ºC下搅拌1h。在一个单独的烧瓶中,用N-二甲基羟胺(21.45 g,0.22 mL)在二氯甲烷(200 mL)中用N-甲基吗啉(24.15 mL,0.22 mol)处理。随着N-甲基吗啉盐酸盐的形成,整个过程始终保持浆状。1h后,将羟胺悬浮液加入到30 min以上的混合酸酐中,温度上升至5ºC。周末在室温下搅拌混合物。(这个反应很可能是在加成时进行的。)在水(200 mL)中加入柠檬酸(50 g)溶液,使反应得到猝灭。有机层被分离出来,用水、饱和的碳酸氢钠水溶液和盐水洗涤。有机层在硫酸镁上干燥,过滤,蒸发成油,在高真空下干燥,以去除残留的溶剂,提供羟肟酸酯(61.7 g,97%)。
参考文献: Urban, F. J.; Jasys, V. J. Org. Process Res. Dev. 2004, 8, 169–175.
向山酯化
在向山偶联中使用了多种烷基吡啶盐;一个典型的例子如下所示。
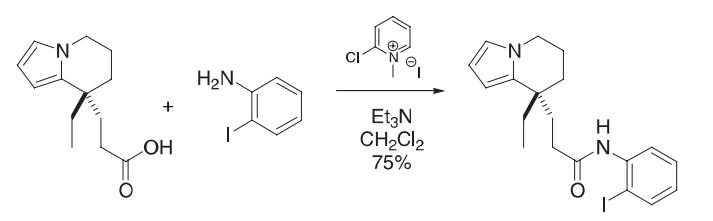
在二氯甲烷(5 mL)的酸(300 mg,1.1 mmol)溶液中加入2-氯-1-甲基吡啶碘化(向山试剂,330 mg,1.3 mmol)和苯胺(1.29 g,5.89 mmol)。将混合物以回流的方式加热1小时,然后允许其冷却。加入Et3N(0.30 mL,2.2 mmol),再回流加热20小时,冷却,倒入水中(40 mL),用二氯甲烷(3×20 mL)提取。组合的有机提取物经过干燥、过滤和浓缩。原油经柱层析(25%乙酸乙酯/己烷)纯化,得到酰胺(387 mg,75%)。
参考文献: Bowie, Jr., A. L.; Hughes, C. C.; Trauner, D. Org. Lett. 2005, 7, 5207–5209.
山田偶联反应
山田的偶联试剂(二乙基氰基膦酸酯,DEPC)是磷基活化剂的代表,包括二苯基磷酸基叠氮化物。
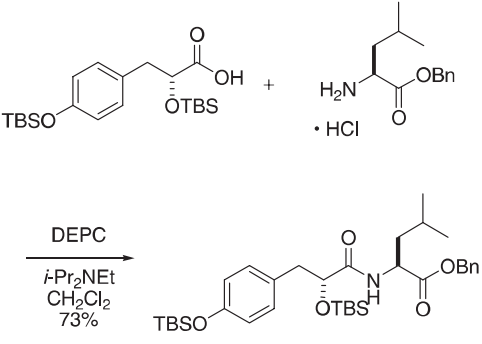
用二异丙基乙基胺(400µL,2.30 mmol)将二氯甲烷(168 mg,0.371 mmol)处理,冷却至−30ºC,然后加入DEPC(100µL,0.659 mmol)。在20分钟内将反应加热至−20ºC,加入HCl·NH2-L-Leu-OBn(282mg,1.09 mmol)的二氯甲烷(1 mL)溶液,并继续搅拌2小时。溶液在Et2O和10%盐酸之间分配,有机层用2n氢氧化钠洗涤,水,干燥(硫酸镁),过滤,浓缩。二氧化硅(己烷/乙酸乙酯,9:1)提供酰胺(178 mg,73%)。
参考文献:Wipf, P.; Methot, J.-L. Org. Lett. 2000, 2, 4213–4216.
山口酯化
山口酯化反应(用三氯苯甲酰氯活化一种酸)通常用于制造大环内酯,表明其可靠性。不幸的是,这些例子通常是在非常小的规模内完成的,因此列举一个不同的例子。
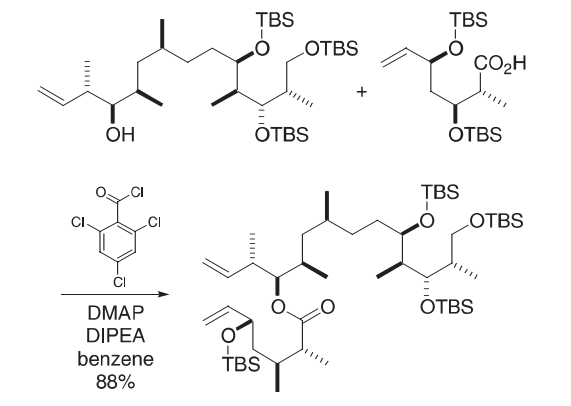
在苯(2.5 mL)中的酸(100 mg,248µmol)的搅拌溶液中加入i-Pr2NEt(99.8µL,573µmol)、Cl3C6H2COCl(85.6µL,548µmol)和DMAP(151 mg,1.24 mmol)。然后将酒精(32.1 mg,124µmol)加入到苯(1.5 mL)中。用苯(1.5 mL)稀释所得的混合物,并继续搅拌20小时。加入苯(50 mL)和饱和碳酸氢钠水溶液(50 mL)。层被分离,用苯(2×50 mL)提取水层。结合的有机层用盐水(50 mL)洗涤,硫酸钠干燥,真空浓缩。闪光色谱(己烷/乙酸乙酯30:1)得到酯(68.0 mg,85%)作为油。
参考文献:Kangani, C. O.; Brückner, A. M.; Curran, D. P. Org. Lett. 2005, 7, 379–382.